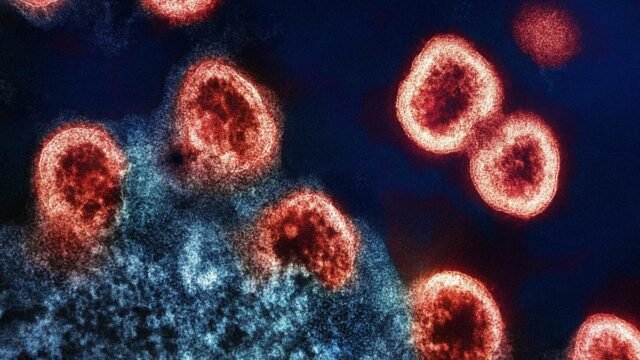
In 1994, a landmark paper in Science reported the isolation of an antibody called B12.from an HIV-infected individual. The study showed that while pooled plasma containing billions of antibodies from HIV patients was able to neutralize viruses isolated from only 3 of 12 patients, B12 alone had similar neutralization in 8 of 12, and that with one-fifth the amount of antibodies present in the pooled plasma.
Other antibodies with similar properties were soon identified that could neutralize a wide range of HIV variants at remarkably low concentrations. This was an exciting development because researchers were beginning to realize that normal antibodies, which are usually among the immune system’s most powerful defenses, were largely ineffective against HIV. These new antibodies, called broadly neutralizing antibodies (BNAs), raised hopes that they might one day help end the pandemic.
Since then, hundreds of BNABs have been identified from various HIV-infected individuals. But despite early excitement, several challenges have prevented them from becoming a long-term “magic bullet” that could end HIV. One major problem is the staggering genetic variation that HIV exhibits. Even within a single patient, countless viral variants coexist, making it virtually impossible for any one BNAB to neutralize every virus. This means that even if someone does indeed produce BNAB, escape variants will persist and keep the infection alive.
BNAB combinations
This could potentially be prevented by administering combinations of BNABs, thereby reducing the chances of the virus escaping. However, HIV has another trick up its sleeve. Once inside, it can lie dormant , not producing new virus particles, and thus evade detection by the immune system. At any given time, millions of cells can be in this dormant state, while others are actively producing viruses. Since BNAB can only neutralize virus particles released from infected cells, the dormant reservoir remains intact. Clearing it would require continuing to treat each dormant cell with a cocktail of BNAB antibodies until it eventually replicates—a process that is expected to take decades.
One possible solution is to train the body to make more bNABs. However, only a small percentage of people with HIV ever develop them . Despite this limitation, vaccine researchers are working to induce the production of bNABs through vaccination. Conventional antibodies, by definition, target specific regions of the pathogen; they usually fail against the HIV virus due to its extreme variability. bNABs are special because they recognize conserved regions of the viral envelope. These are sites that the virus cannot afford to change without jeopardizing its survival. For example, one such location is the site that the virus uses to bind to the CD4 receptor on T-cells during infection. Mutations in this CD4-binding site would render the virus incapable of infecting hosts.
For years, scientists have been testing combinations of BNABs to see which ones are best at neutralizing the many strains of HIV found around the world. HIV can be classified into “subtypes,” which are similar but not identical variants of the virus. Within each subtype, there are countless strains circulating. No single BNAB can block them all. Even within the same subtype, strains can vary in how susceptible they are.
Izšķirt Nesenais papīrs publicēts Viroloģijas žurnāls Pētnieku komanda, kuru vadīja Jayanta Bhattacharya no Translational Health Science & Technology institūta Faridabadas, tagad ir parādījis, ka BNAB efektivitāte var atšķirties arī starp tā paša apakštipa vīrusiem, kas cirkulē dažādos ģeogrāfiskos reģionos.
Pētījumā, ko finansēja DBT/Wellcome Trust India Alliance komandas zinātnes dotācija, salīdzināja 14 labāko pasaules labāko BNAB spēju neitralizēt mūsdienu HIV variantus, kas cirkulē Indijā un Dienvidāfrikā.
Pētnieki atklāja, ka Indijas HIV celmi visefektīvāk tika neitralizēti, plaši neitralizējot antivielas (BNAB), kas ir vērstas uz reģionu uz vīrusa virsmas, kas pazīstama kā V3 glikāns. Antivielas, kas vērstas pret CD4 saistīšanas vietu, arī uzrādīja labu aktivitāti, kaut arī nedaudz mazāk. Turpretī antivielas, kas bija vērstas uz vīrusu smailes olbaltumvielu V1/V2 virsotni, bija daudz mazāk efektīvas, un lielākajai daļai Indijas celmu bija izteikta izturība pret šo klasi. Parādījās arī intriģējošs modelis: vīrusi, kas pretojās neitralizācijai ar V1/V2-APEX antivielām, bieži vien labi kontrolēja ar CD4 saistošo vietņu antivielām.
Balstoties uz šiem novērojumiem, komanda ierosināja jaunu trīs BNAB kokteili, ko sauc par BG18, N6 un PGDM1400, ka viņi prognozē, ka viņi spēj neitralizēt lielu daļu cirkulējošo Indijas HIV-1 celmu ar augstu efektivitāti. Šādas racionālas kombinācijas varētu palīdzēt pārvarēt vīrusa spēju izvairīties no atsevišķām antivielām.
Svarīga mācība
Pētījums arī atklāja pārsteidzošās reģionālās atšķirības. Kad vīrusi no Indijas tika salīdzināti ar Dienvidāfrikas rādītājiem, pētnieki atklāja, ka Indijas celmi ir jutīgāki pret antivielām, piemēram, N6, 10-1074 un BG18, bet nedaudz izturīgākas pret CAP256-VRC26.25. Pēc prof. Bhattacharya teiktā, šīs atšķirības, iespējams, rodas no smalkām vīrusu smailes olbaltumvielu izmaiņām, jo īpaši strukturālajos motīvos, kas veido antivielu saistīšanas vietas. Šie mainītie motīvi var noteikt, vai konkrēta antiviela būs efektīva.
Viņš arī uzsvēra, ka pētījuma rezultāti paver svarīgas iespējas reģionam raksturīgām HIV profilakses stratēģijām, piemēram, paaugstināta riska indivīdu pasīvā imunizācija ar rūpīgi izvēlētiem antivielu kokteiļiem vai vakcīnu dizains, kas izraisa līdzīgi plašas un spēcīgas antivielu reakcijas. Viņš arī uzsvēra nepieciešamību veikt pastāvīgu gan vīrusu daudzveidības, gan antivielu efektivitātes uzraudzību, lai nodrošinātu, ka klīniskās attīstības prioritāte tiek piešķirta daudzsološākajām antivielu kombinācijām.
Kopumā pētījums izceļ svarīgu mācību HIV pētniekiem visā pasaulē. Tā kā HIV ievērojamā ģenētiskā daudzveidība ļauj tai attīstīties atšķirīgi dažādās pasaules daļās, jaunas procedūras un vakcīnas visur var nedarboties vienādi. Kā uzsvēra prof. Bhattacharya, reģionālie pētījumi, piemēram, šis, ir svarīgi, lai projektētu terapiju, kas ir patiesi efektīva globālā mērogā.
Arun Panchapakesan is an assistant professor at the Yr Gaitonde AIDS Research and Education Centre, Chennai.
Published – September 14, 2025 at 05:30